9月1日,我院李春涯教授課題組在腫瘤光動力治療研究方面取得重要研究進展,研究成果以“A Biothiol-Reactive and Mitochondria-Targeting Photosensitizer for Dual-Modal Antitumor Treatment Combining Photodynamic and Nitric Oxide Therapies”為題發表于國際著名期刊《Advanced Functional Materials》。我院2024級博士研究生黎興燦為論文第一作者,李春涯教授、王炎英博士與香港理工大學黃永樑副教授為論文通訊作者,中南民族大學為論文第一署名單位。
光動力療法是非常有前途的微創光治療方式,具有腫瘤選擇性、重復治療和低耐藥性等優點,已用于各種癌癥治療。光敏劑(PS)被特定波長光激發,會產生具細胞毒性的活性氧(ROS),特別是單線態氧(1O2),誘導腫瘤細胞死亡,從而實現光動力治療。然而,由于受到腫瘤微環境和腫瘤細胞強抗氧化性特點的影響,限制了光動力治療在臨床上的應用。
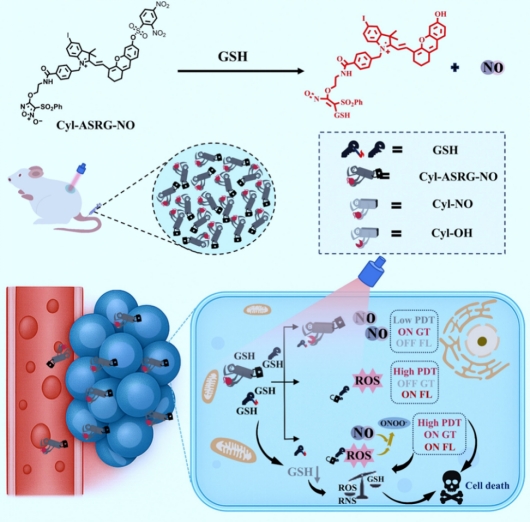
該工作成功合成可被谷胱甘肽(GSH)激活的光動力/氣體協同治療腫瘤d的光敏劑(Cyl-ASRG-NO)。通過在半花菁上偶聯苯磺酰呋喃(PSF)讓光敏劑具備產生NO的能力;引入2,4-二甲基苯磺酰基,通過ICT作用降低光敏劑的ROS產率。當Cyl-ASRG-NO進入腫瘤細胞后,與腫瘤細胞中過表達的GSH反應生成NO,并提升ROS產能。同時,NO和ROS反應生成高毒性的ONOO-,實現腫瘤微環境激活的PDT/氣體協同治療。Cyl-ASRG-NO響應速度快、選擇性好,且能夠靶向線粒體。體外細胞毒性實驗及細胞活死染色實驗表明,Cyl-ASRG-NO具有低的暗毒性和優異的光/氣體毒性,可高效抑制腫瘤細胞生長。同時,活體實驗也表明Cyl-ASRG-NO可有效抑制小鼠腫瘤生長。該方法對于腫瘤聯合治療具有重要的參考價值。
李春涯教授主要從事生物電化學/光電化學傳感、重大疾病相關生物活性分子檢測及成像、腫瘤光動/光熱治療等相關研究,獲取腫瘤標志物高效能分離檢測新策略,優化熒光探針結構、光物理特征及成像性能,探究腫瘤/腦卒中等疾病的致病機理、藥物療效及機制,獲取性能優異的光動/光熱活性材料,并實現腫瘤高效能治療;水凝膠敷料設計制備及糖尿病傷口促愈功能探究,在Advanced Functional Materials、Chemical Science、Small、Analytical Chemistry等雜志發表SCI科研論文140余篇,獲授權國家發明專利10余項,獲湖北省自然科學三等獎1項。主持國家自然科學基金面上項目(4項)、湖北省技術創新專項(重大項目)、湖北省自然科學基金重點項目、武漢市科技攻關及企業橫向合作項目等20余項。
文章信息:Xingcan Lia, Yi Zhang, Qian Ana, Shengze Sua, Yicheng Wanga, Lixia Baia, Ji Zenga, Xing Xua, Wing-Leung Wongb,*, Yanying Wanga,*, Chunya Lia,* A Biothiol-Reactive and Mitochondria-Targeting Photosensitizer for Dual-Modal Antitumor Treatment Combining Photodynamic and Nitric Oxide Therapies, 2025, 08811, DOI: 10.1002/adfm.202508811.
文章鏈接: https://doi.org/10.1002/adfm.202508811
作者:黎興燦 責編:王立 審核:祁帆 發布:張朝沖 發布時間:2025-09-05